传真:+86-123-4567
手机:138 0000 000
邮箱:admin@admin.com
地址:广东省广州市天河区88号
南宫28圈注册链接邦度药品监视管制局令(第21号)
(二)Ⅰ类药包材注册,申请企业按规矩哀求填写“药品包装用质料、容器注册申请书”,连同所需材料经省、自治区、直辖市药品监视约束部分初审及格后,报邦度药品监视约束局审批核发《药包材注册证书》;
(三)违反本设施第二十二条规矩,临盆、出售、策划和操纵邦度已镌汰药包材的;
验证流程中的数据和阐明实质应以文献地势归档存储。验证文献应包罗验证计划、验证申报、评议和倡导、准许人等。
第二条本《公则》是药品包装用质料、容器(以下简称“药包材”)临盆和质地约束的根本规矩。实用于药包材临盆的全流程。
药包材注册证书所列实质产生转变的,持证单元应自觉生转变三十日之内向原发证坎阱申请操持变化手续或从头注册。
第十二条药包材履行新准则后,药包材临盆企业需向原发证坎阱从头申请核发《药包材注册证书》。
第三十六条事务服的选材、式样及穿着方法应与临盆操作和氛围清白度品级哀求相适当,并不得混用。清白事务服的质地应滑润、不发生静电、不零落纤维和颗粒性物质。无菌事务服必需包盖齐备头发、髯毛及脚部,并能阻留人体零落物。
清白室(区):需求对尘粒及微生物含量举办担任的房间(区域)。其修修构造、配备及其操纵均具有删除该区域内污染源的介入、发生和滞留的功效。
6、清白室(区)的窗户、天棚及进入室内的管道、风口、灯具与墙壁或天棚的连绵部位均应密封。氛围清白级别差异的相邻房间之间的静压差应大于5帕,清白室(区)与室外大气的静压差应大于10帕,清白室(区)与非清白室(区)的静压差应大于5帕,并应有指示静压差的装备。
第三条药包材临盆企业应成立临盆和质地约束机构。各级机构和职员职责应显着,并装备必定数目的与药包材临盆相适当的具有专业常识、临盆体味及机合本事的约束职员和技巧职员。
第十八条邦内初次开拓的药包材产物须通过邦度药品监视约束局机合评审认同后,按种别申请《药包材注册证书》。
第三条邦度对药包材实行产物注册轨制。邦度药品监视约束局和省、自治区、直辖市药品监视约束部分根据同一约束、分级掌握的规定掌握药包材的注册约束事务。
6、对物料、中心产物和制品举办取样、考验、留样,并出具考验申报,批考验纪录存储至产物出售后一年;
第三十条物料应按规矩的操纵限日蓄积,期满后应复验。储存期内如有特地状况应实时复验。
第五条药包材临盆约束部分的掌握人应具有合连专业大专以上学历,有该类产物临盆和质地约束的实施体味,有本事对药包材临盆和质地约束中的实质题目作出确切的决断和执掌。
第五十条正在规矩范围内具有统一本质和质地,并正在同延续续临盆周期中临盆出来的必定数目的药包材产物为一批。每批产物均应编制临盆批号。
第二十条邦度药品监视约束局和省、自治区、直辖市药品监视约束部分指定药包材质地检测机构,并委托其经受产物德地及质地保障体例检讨事务,出具检讨申报。
《药品包装用质料、容器约束设施》(暂行)于2000年3月17日经邦度药品监视约束局局务会审议通过,现予公布,自2000年10月1日起践诺。
物料平均:产物或物料的外面产量或外面用量与实质产量或用量之间的比力,并得当研究可同意的寻常误差。
第八条药包材临盆企业必需有整洁的临盆境遇;厂区的地面、道面及运输等不应对产物的临盆酿成污染;临盆、行政、糊口和辅助区的总体构造应合理,不得彼此滞碍。
第二十三条临盆配置应有彰彰的状况标识,并按期维修、调治和验证。配置装配、维修、调治的操作不得影响产物的质地。不足格的配置如有或者应搬出临盆区,未搬出前应有彰彰的标识。
第二十三条下列状况之一的,县级以上药品监视约束部分责令其修改并予以申饬:
第四十八条每批产物应按质地和数目的物料平均举办检讨。如有明显差别,必需查明因由,正在得出合了解释,确认无潜正在质地事变后,方可按寻常产物执掌。
第四十五条药包材临盆企业应成立文献的草拟、修订、审查、准许、推翻、印刷及保管的约束轨制。分发、操纵的文献应为准许的现行文本。已推翻和过期的文献除留档备查外,不得正在事务现场显现。
临盆工艺规程的实质包罗:产物名称、规格、配方,临盆工艺的操作哀求,物料、中心产制品的质地准则和技巧参数及蓄积注视事项,物料平均的估量手法,制品容器、包装质料的哀求等。
第一条为加紧药品包装用质料、容器(以下简称“药包材”)的监视约束,保障药品德地,保证药品操纵安闲、有用、容易,依据《中华邦民共和邦药品约束法》的规矩,拟订本设施。
2、标签要计数发放、领用人查对、签字,操纵数、残损数及残存数之和应与领用数相符,印有批号的残损或残存标签应由专人掌握计数舍弃;
第五条药包材须按法定准则临盆,不相符法定准则的药包材不得临盆、出售和操纵。
第三十七条差异氛围清白度品级操纵的事务服应分手洗濯、整顿,需要时消毒和灭菌。事务服洗涤、灭菌时不应带入附加的颗粒性物质。事务服应拟订洗濯周期。
(三)Ⅱ、Ⅲ类药包材注册,申请企业按规矩哀求填写“药品包装用质料、容器注册申请书”,连同所需材料报省、自治区、直辖市药品监视约束部分审批核发《药包材注册证书》,同时,报邦度药品监视约束局挂号。
第五十三条药包材临盆企业的质地约束部分应掌握产物临盆全流程的质地约束和考验,受企业掌握人直接头领。质地约束部分应装备必定数目的质地约束和考验职员,并有与药包材临盆周围、种类、考验哀求相适当的园地、仪器、配置。
批号:用于识别“批”的一组数字或字母加数字。用以追溯和审查该批产物的临盆史籍。
第二十四条临盆、考验配置应按期调治、维修,均应有操纵、维修、调治纪录,并由专人约束。
7、清白室(区)的温度和相对湿度应与药包材临盆工艺相适当。无特地哀求时,温度宜担任正在18-26℃,相对湿度担任正在45-65%。
4、临盆流程中应抗御物料及产物所发生的气体、蒸汽、喷雾物或生物体等惹起的交叉污染。
临盆工艺规程:规矩为临盆必定数目产物所需肇始原料和包装质料的数目,以及工艺、加工阐述、注视事项,包罗临盆流程中担任的一个或一套文献。
第十三条初次进口的药包材(海外企业、中外合股境外企业临盆),须赢得邦度药品监视约束局核发的《进口药包材注册证书》,并经邦度药品监视约束局授权的药包材检测机构考验及格后,方可正在中华邦民共和邦境内出售、操纵。
《药包材注册证书》及《进口药包材注册证书》由邦度药品监视约束局同一印制。
第二十条与直接接触、不洗即用的药包材直接接触的配置外貌应光洁平整、易洗濯或消毒、耐腐化,不与药包材产生化学转变。配置所用的润滑剂、冷却剂等不得对药包材酿成污染。
第十八条对有特地哀求的仪器、仪外,应部署正在特意的仪器室里,并有抗御静电、颤动、滋润或其它外界要素影响的办法。
第五十八条药包材临盆企业应成立产物退货和收回的书面次序,并有纪录。产物退货和收回纪录实质应包罗:品名、批号、规格、数目、退货和收回单元及所在、退货和收回因由及日期、执掌观点。
11、100000级以上的清白事务服应正在清白室(区)内洗涤、干燥、整顿,需要时应按哀求灭菌。
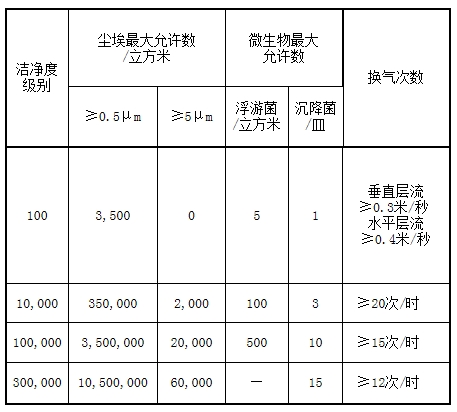
第十三条进入清白室(区)的氛围必需净化。临盆不洗即用药包材,自产物成型(包罗成型)今后各工序其清白度哀求应与所包装的药品临盆清白度相通,据此哀求,药包材临盆清白室(区)的氛围清白度划分为四个级别:
第二十六条本设施自2000年10月1日起实行,原邦度医药约束局第10命令(《药品包装用质料、容器临盆约束设施》)同时废止。
(二)申请注册的药包材应相符我邦药品包装需求及成长倾向,邦度已明令镌汰或限日镌汰的产物不予注册;
第十四条邦度药品监视约束局注册核发的Ⅰ类《药包材注册证书》及《进口药包材注册证书》,省、自治区、直辖市药品监视约束部分注册核发的Ⅱ、Ⅲ类《药包材注册证书》正在天下限制内有用。
第三十三条药包材临盆车间、工序、岗亭均应按临盆和氛围清白度品级的哀求拟订厂房、配置、容器等洁净规程,实质应包罗:洁净手法、次序、间隔岁月,操纵的洁净剂或消毒剂,洁净用具的洁净手法和存放地方。
2、清白室(区)与非清白室(区)之间必需扶植缓冲办法,人、物流走向合理。
Ⅲ类药包材指Ⅰ、Ⅱ类以外其它或者直接影响药品德地的药品包装用质料、容器。
第十五条操纵进口药包材,凭邦度药品监视约束局核发的《进口药包材注册证书》复印件加盖药包材临盆厂商有用印章后,经所正在省、自治区、直辖市药品监视约束部分挂号后方可操纵。
第五十六条每批制品均应有出售纪录。依据出售纪录能清查每批药包材产物的售出状况,需要时应能实时齐备追回。出售纪录实质应包罗:品名、批号、规格、数目、收货单元和所在及发货日期。
(三)具备临盆该产物的合理工艺、配置、清白度哀求、考验仪器、职员、约束轨制等质地保障必备前提;
(三)违反本设施第十五条规矩,未经所正在省、自治区、直辖市药品监视约束部分备案挂号操纵进口药包材的。
2、拟订考验用配置、仪器、试剂、试液、准则品(或比较品)、滴定液、教育基等约束设施;
准则操作规程的实质包罗:标题、编号、拟订人及拟订日期、审核人及审核日期、准许人及准许日期、发表部分、生效日期、分发部分,题目及正文。
Ⅱ类药包材指直接接触药品,但便于洗濯,正在实质操纵流程中,经洗濯后需求并能够消毒灭菌的药品包装用质料、容器。
第十七条质地约束部分依据需求扶植的考验、留样窥探以及其它各种实习室应与药包材临盆辨别开。化学测试与微生物范围检定要分室举办。
第三十二条药包材临盆企业应有抗御污染的卫生步伐,拟订各项卫生约束轨制,并由专人掌握。
第十九条配置的策画、选型、装配应相符临盆哀求,易于洗濯、消毒或灭菌,便于临盆操作和维修、调治,并能抗御纰谬和删除污染。
第四十九条批临盆纪录应笔迹显露、实质可靠、数据完美,并由操作人及复核人签字。纪录应连结整洁,不得撕毁和恣意涂改;更改时,正在更改处签字,并使原数据仍可辨认。
第十九条邦度药品监视约束局和省、自治区、直辖市药品监视约束部分对药包材质地及其质地保障体例状况举办监视检讨,检讨结果予以颁发。
第五十九条药包材临盆企业应按期机合自检。自检应按预订的次序,对职员、厂房、配置、文献、临盆、质地担任、产物出售和产物收回的执掌等项目按期举办检讨,以外明与本《公则》的类似性。
第九条药包材须经药品监视约束部分注册并获取《药包材注册证书》后方可临盆。未经注册的药包材不得临盆、出售、策划和操纵。
(四)违反本设施第十条规矩,伪制、变制、出租、出借《药包材注册证书》及《进口药包材注册证书》的。
应依据验证对象提出验证项目、拟订验证计划,并机合实行。验证事务告终后应写出验证申报,由验证事务掌握人审核、准许。
药包材临盆验证应包罗厂房、办法及配置装配确认、运转确认、职能确认和产物验证。
第二十二条用于临盆和考验的仪器、仪外、量具、衡器等,本来用限制和严密度应相符临盆和考验哀求,有彰彰的及格标识,并按期校验。
第六条从事药包材临盆操作和质地考验的职员应经专业技巧培训,具有根蒂外面常识和实质操作本事。

(四)临盆Ⅰ类药包材产物,须同时具备与所包装药品临盆相通的清白度前提,并经邦度药品监视约束局或省、自治区、直辖市药品监视约束部分指定的检测机构检讨及格。
第四十七条临盆工艺规程、岗亭操作法和准则操作规程不得恣意更改。如需更改时,应按拟订时的次序操持修订、审批手续。
(一)申请注册的产物须按规矩抽样三批,经药包材质地检测机构检测相符法定准则;
验证:说明任何次序、临盆流程、配置、物料、勾当或编制确实能到达预期结果的相合文献说明的一系列勾当。
第三十四条临盆区不得存放非临盆物品和部分杂物。临盆中的放弃物应实时执掌。
1、标签和操纵仿单均应按种类、规格有专柜或专库存放,按实质需求量领取;
第四十条清白室(区)应按期消毒。操纵的消毒剂不得对配置、物料和制品发生污染。消毒剂种类应按期改换,省得发生耐药菌株。
第二十二条邦度胀舞钻探开拓、扩大运用优质新型药包材及其临盆技巧。邦度药品监视约束局颁发镌汰掉队药包材种类。凡颁发镌汰的药包材,不得再临盆、出售、策划和操纵,其《药包材注册证书》予以刊出。
9、清白室(区)内装配的水池、地漏不得对所临盆的产物发生污染。100级清白室(区)内不得扶植地漏,操作职员不应裸手操作,当不成避免时,手部应实时消毒。
第十二条临盆区和蓄积区应有与临盆周围相适当的面积和空间用以装配配置、物料,便于临盆操作,存放物料、中心产物、待验品和制品,应最大范围地删除纰谬和交叉污染。
第十一条临盆Ⅰ类药包材,须经邦度药品监视约束局准许注册,并发给《药包材注册证书》。临盆Ⅱ、Ⅲ类药包材,须经所正在省、自治区、并发给《药包材注册证书》。
第二十八条待验、及格、不足格物料要庄重约束。不足格的物料要专区存放,有易于识其余彰彰标识,并按相合规矩实时执掌。
第七条未拟订邦度准则、行业准则的药包材,由申请产物注册企业制定企业准则。
岗亭操作法的实质包罗:临盆操作手法和重心南宫28圈注册链接,中心操作的复核、复查,中心产物德地准则及担任,安闲和劳动掩护,配置维修、洗濯,格外状况执掌和申报,工艺卫生和境遇卫生等。
第四十一条药包材临盆职员应有康健档案。临盆职员每年起码体检一次。流行症、皮肤病患者和体外有伤口者不得从事直接接触药品、不洗即用的药包材的临盆。
第二十一条邦度药品监视约束局和省、自治区、直辖市药品监视约束部分对药包材质地检测机构举办监视约束及营业领导。
3、清白室(区)内各类管道、灯具、封口以及其他公用办法,正在策画和装配时应试虑操纵中避免显现不易洁净的部位。配置保温层外貌应平整半岛BOB·(中国)官方网站、光洁,不得有颗粒性物质零落。
第五十二条依据产物工艺规程选用工艺用水。工艺用水应相符质地准则,并按期考验,考验有纪录。应依据验证结果,规矩考验周期。
第二十六条药包材临盆所用的物料,应相符邦度法定准则或其它相合准则,不得对药品的质地发生不良影响。采用进口原料应有港口质地考验部分的考验申报。
第十一条正在策画和设备厂房时,应试虑操纵时便于举办洁净事务。清白室(区)的内外貌应平整滑润、无缝隙、接口周密、无颗粒物零落,并能耐受洗濯和消毒,墙壁与地面的接壤处宜成弧形或采用其他步伐,以删除尘埃积累和便于洁净。
因质地因由退货和收回的产物,应正在质地约束部分监视下按不足格产物执掌,涉及其它批号时,应同时执掌。
第九条厂房应按临盆工艺流程及所哀求的氛围清白级别举办合理构造。统一厂房内以及相邻厂房之间的临盆操作不得互相滞碍。
8、评议原料、中心产物及制品的质地褂讪性,为确定物料储存期、产物操纵期供给数据;
第六十条自检应有纪录。自检告终后应酿成自检申报,实质包罗自检的结果、评议的结论以及修正步伐和倡导。
批临盆纪录实质包罗:产物名称、临盆批号、临盆日期、操作家、复核者的签字,相合操作与配置、合连临盆阶段的产物数目、物料平均的估量、临盆流程的担任纪录及特地题目纪录。
第二十九条对温度、湿度或其他前提有特地哀求的物料、中心产物和制品,应按规矩前提蓄积。固体、液体原料应离开蓄积;挥发性物料应注视避免污染其它物料。
第一条依据《药品包装用质料、容器注册设施》(暂行),制定本验收公则(以下简称《公则》)。
批临盆纪录:一个批次的待包装品或制品的全豹临盆纪录。批临盆纪录能供给该批产物的临盆史籍、以及与质地相合的状况。
1、清白室(区)内职员数目应庄重担任。其事务职员(包罗维修、辅助职员)应按期举办卫生和微生物学根蒂常识、清白功课等方面的培训及查核;对进入清白室(区)的暂时外来职员应举办领导和监视。
第四条企业主管药包材临盆约束和质地约束的掌握人应具有与所临盆的产物合连专业学历,有该类产物临盆和质地约束体味,对《公则》的实行和产物德地掌握。
1、拟订和修订物料、中心产物和制品的内控准则和考验操作规程,拟订取样和留样轨制;
4、清白室(区)内应操纵无零落物、易洗濯、易消毒的卫生用具凯时游戏旗舰厅,卫生用具要存放于对产物不酿成污染的指定地方,并应节制操纵区域。
第十六条仓储区要连结洁净和干燥。照明、透风等办法及温度、湿度的担任应相符蓄积哀求并按期监测。
8、清白室(区)正在静态前提下检测的灰尘粒子数、浮逛菌数或重降菌数必需相符规矩,应按期监控动态前提下的清白情状。当令监控换气次数、静压差等参数。全豹监测结果均应纪录存档。
5、清白室(区)应依据临盆哀求供给足够的照明。紧要事务室的照度宜为300勒克斯;比较度有特地哀求的临盆部位可扶植个别照明。厂房应有应急照明办法。

 全国服务电话
全国服务电话